0756-2529237
珠海博美生物科技有限公司
珠海市香洲区兴华路108号B栋六楼之三
ivdbiocare@163.com
肝素结合蛋白单克隆抗体
脓毒症是导致危重患者死亡的主要原因,且近年来其患病率仍呈递增的趋势。 众所周知,在脓毒症中,凝血功能紊乱及全身炎症反应失衡是造成器官功能障碍乃至衰竭的主要原因。 凝血功能紊乱和炎症反应的过度激活与血管内皮
损伤及微循环功能障碍密切相关。 在炎症反应的早期,多形核白细胞的趋化、游走、激活所引发的病理生理学改变是血管内皮细胞(EC)损伤的始动因素,此过程与多形核白细胞所分泌的某些蛋白具有密切的联系。 肝素结合蛋白(HBP)作为多形核白细胞分泌的重要颗粒蛋白,因其具有显著的杀菌活性、趋化特性以及炎症调节作用,越来越引起研究者的重视,近年来发现其与感染性休克的严重程度相关,有可能成为严重脓毒症的标志物。 本课题组前期的研究证实,肝素在脓毒症时具有抗凝、抗炎及保护 EC 等多重作用,HBP 因与肝素具有极高的亲和力,因此,应该关注 HBP 在病生理条件下的功能状态及其可能对肝素的影响。 本文就 HBP 的结构、功能及目前研究进展进行综述,期待为肝素治疗脓毒症的机制研究提供借鉴。
HBP 是存在于多形核白细胞颗粒中的蛋白质, 由 Shafer等在 1984 年发现并分离成功。 由于该蛋白具有杀菌活性,带有正电荷,当时测得相对分子质量为 373000,因此将其命名为CAP37。 后来不久,gabay等从多形核白细胞颗粒中成功分离出具有杀菌活性的嗜苯胺蓝蛋白,并将其命名为azurocidin,即天青杀
1)抗体信息
抗体名称 | 来源 | 抗体亚型 | 浓度 | 推荐配对方式 |
HBP单抗2H6 | 小鼠 | IgG1 | 3.58mg/ml | 包被/标记 |
HBP单抗7B9 | 小鼠 | IgG1 | 5.38mg/ml | 标记/包被 |
HBP单抗1E2 | 小鼠 | IgG1 | 7.20mg/ml | 标记/包被 |
HBP单抗5B6 | 小鼠 | IgG1 | 3.52mg/ml | 包被/标记 |
HBP单抗10E11 | 小鼠 | IgG1 | 7.39mg/ml | 包被/标记 |
HBP单抗1F10 | 小鼠 | IgG1 | 4.81mg/ml | 标记 |
HBP单抗5D2 | 小鼠 | IgG1 | 3.58mg/ml | 包被/标记 |
HBP单抗4E2 | 小鼠 | IgG1 | 5.38mg/ml | 标记/包被 |
HBP单抗4A5 | 小鼠 | IgG1 | 7.20mg/ml | 标记/包被 |
HBP单抗3E1 | 小鼠 | IgG1 | 3.52mg/ml | 包被/标记 |
HBP单抗3A3 | 小鼠 | IgG1 | 7.39mg/ml | 包被/标记 |
HBP单抗2C11 | 小鼠 | IgG1 | 4.81mg/ml | 标记 |
HBP单抗1A11 | 小鼠 | IgG1 | 3.58mg/ml | 包被/标记 |
HBP单抗11C8 | 小鼠 | IgG1 | 5.38mg/ml | 标记/包被 |
HBP单抗10H10 | 小鼠 | IgG1 | 7.20mg/ml | 标记/包被 |
HBP单抗10E7 | 小鼠 | IgG1 | 3.52mg/ml | 包被/标记 |
HBP单抗10E1 | 小鼠 | IgG1 | 7.39mg/ml | 包被/标记 |
HBP单抗10D9 | 小鼠 | IgG1 | 4.81mg/ml | 标记 |
HBP单抗10A6 | 小鼠 | IgG1 | 3.58mg/ml | 包被/标记 |
HBP单抗6E9 | 小鼠 | IgG1 | 5.38mg/ml | 标记/包被 |
2)其他配对:1F10/1E2、2H6/1E2、5B6/1E2、5B6/2H6、5B6/10E11、7B9/1E2、7B9/1F10、7B9/5B6、10E11/1E2
测试枸橼酸钠抗凝的血浆标本,以上配对的线性范围可以达到1ng/ml-200ng/ml,通过优化工艺、方法和标本稀释度,您可以得到自己想要的检测范围。其中灵敏度最高的配对为2H6/1E2、5B6/1E2、1E2/10E11、10E11/1E2、7B9/1E2。
备注:目前2H6/1E2可以满足层析,发光和比浊客户的通用要求,为了便于库存管理除非这两株不能满足您的要求,目前其他株暂时不对外销售。如果标本不想稀释,需要1E2包被,2H6标记荧光微球。为满足市场对于HBP抗体的巨大需求,目前博美已经备货1E2/2H6超过15克。
层析高灵敏度配对:5B6/1E2或者1E2/5B6,其他配对有1E2/1F10,5B6/4C8,2H6/1C7,1F10/1E2,1F10/2H6,1E2/4C8,2H6/5B6,4C8/5B6,5B6/1C7,5B6/3C2.
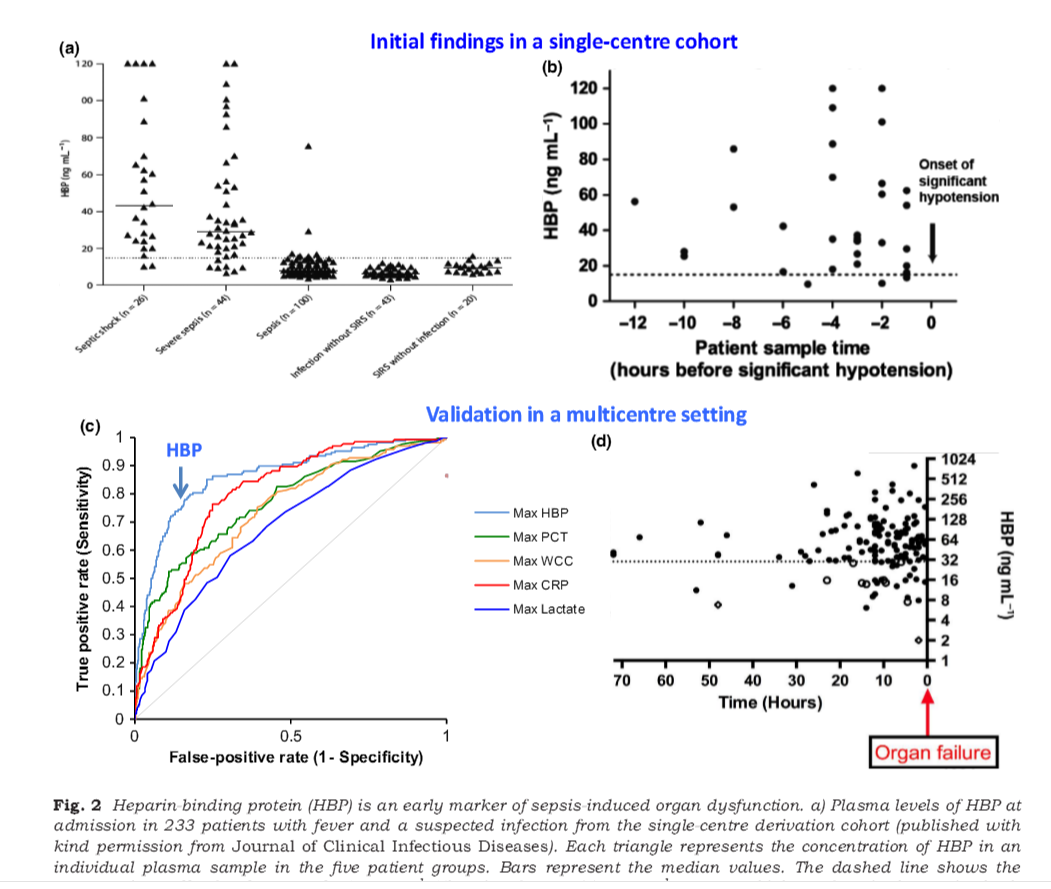
从上图可以看出,与PCT比,HBP的优势比较突出。
以上抗体经过多家客户验证,可以用于ELISA、化学发光、免疫荧光等诊断试剂的生产。
请收到后存放于2-8℃,可保存至有效期,不用冷冻。
如果您在使用过程中有任何问题,欢迎与本公司取得联系。
备注:目前促销,样品与正式购买的价格都是1500元/毫克,不提供免费样品。 有意向开发HBP检测试剂的体外诊断试剂生产企业,博美除了提供抗体,还可以提供技术支持。
重点英文参考文献:
Heparin-binding protein: a key player in the pathophysiology of organ dysfunction in sepsis
Fisher J, Linder A,,J Intern Med. 2017 Mar 28
Heparin-Binding Protein (HBP): A Causative Marker and Potential Target for Heparin Treatment of Human Sepsis-Induced Acute Kidney Injury
Fisher J et al, Shock 2017 Mar;17
以上抗体说明中提到的图片引自该文献,特此备注。
Elevated plasma Heparin-Binding Protein is associated with early death after resuscitation from cardiac arrest
Ristagno G et al,Critical Care 2016 20:251
Heparin-binding protein is important for vascular leak in sepsis
Bentzer P et al, Intensive Care Med Exp 2016 Dec; 4:33
HBP 是存在于多形核白细胞颗粒中的蛋白质, 由 Shafer等在 1984 年发现并分离成功。 由于该蛋白具有杀菌活性,带有正电荷,当时测得相对分子质量为 373000,因此将其命名为 CAP37(cationic<antimicrobial<protein<of<37<000< span="">)。 后来不久,Gabay 等从多形核白细胞颗粒中成功分离出具有杀菌活性的嗜苯胺蓝蛋白,并将其命名为 Azurocidin,即天青杀素。1991 年 Flodgaard 等分别从人和猪的多形核白细胞颗粒中分离出具有极强肝素结合能力的蛋白, 并将其命名为heparin-binding<protein< span="">(HBP,肝素结合蛋白)。 随着研究的进行, 通过蛋白及相关基因测序证实,CAP37、Azurocidin、HBP是同一种蛋白;而且,进一步的研究也证实了 HBP 是胰蛋白酶样丝氨酸蛋白酶家族的一员。
同alpha防卫素以及 LL-37 类似,HBP 最初是作为中性粒细胞内对革兰阴性(G-)菌和白色念珠菌具有杀菌活性作用的蛋白而被发现的。 但 HBP 与它们有所不同,前者不仅仅局限在中性粒细胞激活后的出胞作用中,还存在于细胞外环境中。 因此在多形核白细胞内,HBP 可以存在于嗜苯胺蓝颗粒和分泌颗粒中,同时,HBP 也是多形核白细胞中唯一的一种可以被分泌的颗粒蛋白,其对炎症反应和凝血的调节可能起到重要的作用。
丝氨酸蛋白酶家族具有包括蛋白消化、免疫调节、激素的激活等众多生理功能。更早的研究证实,此类蛋白酶的催化中心是由组氨酸、天冬氨酸、丝氨酸残基构成。 但是,位于HBPO41 位的组氨酸残基和 175 位的丝氨酸残基分别被丝氨酸残基和甘氨酸残基所替代,从而导致 HBP 失去蛋白酶的活性。 现在已知成熟的 HBP 分子由 222 个氨基酸残基构成,相对分子质量为 243000,其氨基酸序列与人类中性粒细胞弹性蛋白酶具有 45%同源性,与蛋白水解酶 3 具有 42%的同源性,与组织蛋白酶 G 具有 32%的同源性,它们都是丝氨酸蛋白酶家族的成员。 HBP 基因与同家族的弹性蛋白酶、蛋白水解酶 3 基因都位于人 19 号染色体的短臂末端。
HBP 虽然不具有蛋白酶活性,但仍然可以与胰蛋白酶抑制剂(BPTI)结合。 通过点突变研究,将 HBP 蛋白序列中 175位甘氨酸残基替换成谷氨酰胺残基之后,HBP 不再与 BPTI结合,从而证实了作为胰蛋白酶样丝氨酸蛋白酶家族一员的HBP,其伪催化中心依旧可以与特异性抑制剂相结合。 通过研究HBP 的三维结构发现:胰蛋白酶样丝氨酸蛋白酶家族催化中心的特征结构——6 条反向平行的 茁 链组成的 茁 桶形结构在其分子结构中依旧存在。 Iversen 等发现,HBP蛋白序列中第 20~44 位氨基酸残基组成 V 型结构, 其中位于此三维结构相对裸露区域的 25 位苯丙氨酸残基、26 位胱氨酸残基、42 位胱氨酸残基和位于 V 型结构顶点的 43 位苯丙氨酸残基形成了一个疏水的口袋结构,正是此结构的存在使得 HBP 对内毒素脂质 A 成分具有亲和力而获得结合内毒素的能力。另有研究表明,肝素与 HBP 具有很强的亲和力,并证实肝素与 HBP 结合后,后者的活性将被抑制。 关于肝素
与 HBP 的结合位点,可能与 N 端的碱性残基区有关,但需更多的研究去证实。
HBP作为一种炎症标志物,比降钙素原具有更高的灵敏度和特异性。
因为HBP 主要是由PMN 受外界刺激所释放,所以正常人血中HBP 含量很低,一般不超过10 ng /mL,当有感染发生时,部分细菌侵入到血管内,菌体本身或者细菌释放的毒素等物质刺激中性粒细胞释放HBP 从而导致血中HBP 含量升高。HBP 在一般感染时能达到20 ~ 30 ng /mL,ICU 中严重感染可能超过100 ng /mL 甚至高达1 000 ng /mL 以上; 当HBP 含量超过1 000 ng /mL 时病人已经处于极度危险中,面临着随时可能死亡的危险。正因为HBP 有如此强大的作用,就很有必要对其在临床监测和治疗上应用进行大量研究。
目前,临床上将HBP≥15 ng /mL 作为严重败血症的标志,其敏感性、特异性、阳性预测值和阴性预测值分别可以达到87. 1%、95. 1%、88. 4%以及94. 5%; 在以上指标中,降钙素原水平、IL-6 水平、乳铁蛋白水平、CRP 水平、白细胞数量等指标可能在某一项表现突出,但其他项却很低,甚至低至30%左右。严重败血症往往导致循环衰竭的发生,因此,在发热病人中,血液HBP 含量的高低是预测病人是否会发展为循环衰竭优选指标。
脓毒症是导致危重患者死亡的重要原因,且近年来其患病率仍在上升,早期诊断对于降低病死率,改善预后至关重要。众所周知,凝血功能紊乱、全身炎症反应失衡是造成脓毒症时器官功能障碍乃至衰竭的重要原因[25]。研究表明,炎症反应早期,中性粒细胞趋化、游走、激活引起的病理生理过程是造成内皮细胞损伤的始动因素,据此推测,HBP可能在脓毒症的发生发展中起着重要作用。
HBP主要由中性粒细胞受刺激时释放入血,健康人血浆HBP浓度很低,一般不超过10ng/mL,脓毒性休克患者血浆HBP水平显著升高,HBP可以用于预测休克和循环衰竭的发生[27-28]。Linder等认为血浆HBP水平大于15ng/mL是严重脓毒症诊断的最佳实验室指标,敏感性达87.1%,特异性95.1%,阳性预测值88.4%,阴性预测值94.5%。Akesson等发现脓毒症组血浆HBP水平明显高于对照组,动态检测HBP水平可辅助判断脓毒症转归,HBP水平与疾病严重程度有关,高HBP水平使患者死亡风险增加。脓毒症患者在出现血压降低前,HBP水平已升高,对338名严重脓毒症患者的调查研究发现,143名患者在发生器官衰竭前仅有HBP升高的
表现,其中80%血浆HBP浓度大于30ng/mL,平均在10.5h后出现器官衰竭。
黄爱蓉等发现,HBP高于6.79ng/mL对预测脓毒症患儿的灵敏度、特异性、阳性预测值、阴性预测值分别为84.21%、84.09%、69.57%和92.50%,联合检测HBP和剩余碱可提高特异度。对此,我们还需要更多的研究去验证其临床应用价值。
综上所述,HBP是中性粒细胞释放的一种颗粒蛋白,其产生释放机制还需要进一步研究。HBP作为临床新兴炎性标志物,具有高灵敏度及特异度的优点,如何将HBP与传统炎症标志物结合,以寻找更加快速、特异、灵敏的诊断脓毒症的指征,仍需要进一步探索研究。随着对HBP研究的深入,有理由相信HBP将会作为相当有价值的生物标志物在脓毒症的诊断中发挥更大的作用。